CMS merilis panduan negosiasi harga IRA minggu lalu. Berikut beberapa hal penting tentang bagaimana obat akan dipilih.
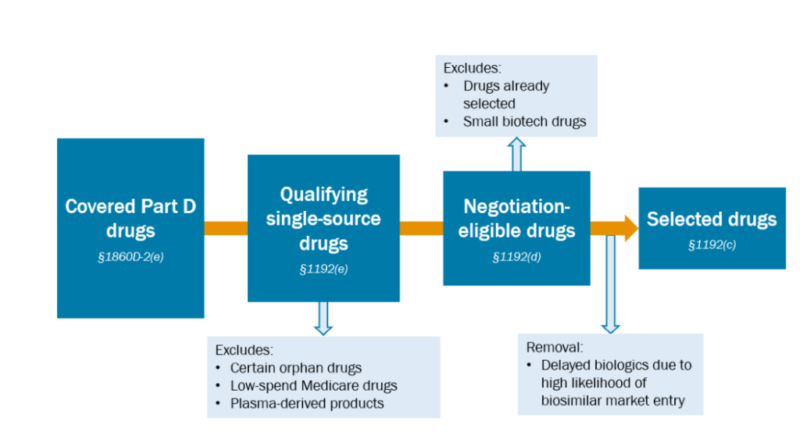
Obat mana yang memenuhi syarat untuk dinegosiasikan?
- Untuk molekul kecil, obat tersebut harus (i) disetujui FDA, (ii) disetujui FDA setidaknya 7 tahun yang lalu, dan (iii) tidak memiliki obat generik yang setara di pasaran.
- Untuk molekul biologis, obat tersebut harus (i) disetujui FDA, (ii) disetujui FDA setidaknya 11 tahun yang lalu, dan (iii) tidak memiliki biosimilar yang setara di pasaran.
Kombinasi obat yang selalu diresepkan bersamaan akan dianggap sebagai satu pengobatan.
Obat-obatan yang berada di peringkat 15 besar untuk belanja Bagian D antara tanggal 1 November 2023 dan 31 Oktober 2024 akan dianggap memenuhi syarat untuk dinegosiasikan.
Bagaimana suatu obat memenuhi syarat untuk pengecualian obat yatim piatu?
Pengobatan harus diindikasikan hanya untuk 1 kondisi langka. CMS menyatakan bahwa “Obat yang memiliki sebutan yatim piatu untuk lebih dari satu penyakit atau kondisi langka tidak akan memenuhi syarat untuk Pengecualian Obat Yatim Piatu, meskipun obat tersebut belum disetujui untuk indikasi apa pun untuk penyakit atau kondisi langka tambahan tersebut. ).
Bagaimana obat-obatan memenuhi syarat untuk pengecualian pembelanja rendah?
Obat-obatan dengan gabungan pengeluaran Medicare tahunan kurang dari $200 juta tidak akan dipertimbangkan untuk negosiasi harga. $200 mencakup pengeluaran Bagian B dan Bagian D selama periode 1 November 2023 dan berakhir pada 31 Oktober 2024. Ambang batas $200 juta akan disesuaikan dengan inflasi (CPI-U) di tahun-tahun mendatang. Total biaya yang diperbolehkan (misalnya Medicare, penerima manfaat, dan pembayaran pihak ketiga lainnya) akan digunakan untuk menghitung apakah obat memenuhi ambang batas ini. Jika suatu obat Bagian B digabungkan dengan obat lain dalam satu kode HCPCS, maka CMS akan menggunakan data harga jual rata-rata (ASP).
Apakah produk turunan plasma dikecualikan dari negosiasi harga?
Ya.
Bagaimana perusahaan memenuhi pengecualian kecil di bidang bioteknologi?
CMS menggunakan dua aturan dasar:
- Bagian non-materiil dari biaya Bagian D
- Penjualan obat-obatan biotek skala kecil merupakan mayoritas penjualan. CMS mengharuskan setidaknya 80% pengeluaran Bagian D perusahaan dibebankan pada obat yang dipertimbangkan. Logika CMS kemungkinan besar adalah jika sebuah perusahaan memiliki banyak obat untuk dijual, kemungkinan besar perusahaan tersebut bukanlah perusahaan bioteknologi kecil. Namun, jika sebuah bioteknologi kecil memiliki 1 obat utama dan satu obat baru saja memasuki pasar, mereka tidak ingin memberikan sanksi kepada perusahaan bioteknologi kecil tersebut karena membawa obat lain ke pasar. Namun yang jelas, ketentuan ini akan mengurangi insentif bagi perusahaan untuk memasarkan obat kedua (atau ketiga) dan kita dapat melihat perusahaan bioteknologi kecil menciptakan perusahaan spin-off ketika obat kedua dan ketiga mulai dipasarkan.
Bagaimana CMS menentukan apakah suatu biosimilar kemungkinan akan memasuki pasar?
CMS mengharuskan produsen biosimilar mengajukan permintaan penangguhan ini. Produsen biosimilar harus (i) menjadi pemegang BLA untuk biosimilar tersebut atau (ii) jika biosimilar tersebut belum memiliki izin, perusahaan tersebut harus menjadi sponsor BLA yang telah diajukan untuk ditinjau oleh FDA. Namun, CMS tidak akan mempertimbangkan untuk menunda biosimilar jika perusahaan biosimilar tersebut telah diberikan BLA lebih dari setahun yang lalu, namun belum mulai memasarkan produknya. Selain itu, produsen biosimilar mungkin bukan produsen yang sama dengan produk biologis referensi. Untuk memastikan kemungkinan besar biosimilar memasuki pasar, CMS mensyaratkan bahwa (i) tidak ada paten yang beredar, (ii) perusahaan biosimilar memberikan “pengungkapan tentang investasi modal, ekspektasi pendapatan, dan tindakan yang konsisten dengan jalannya bisnis normal. untuk memasarkan produk biologis biosimilar,” (iii) memiliki perjanjian dengan FTC untuk memasarkan produk tersebut, dan (iv) bahwa jadwal produksi telah diserahkan ke FDA.
NewsRoom.id