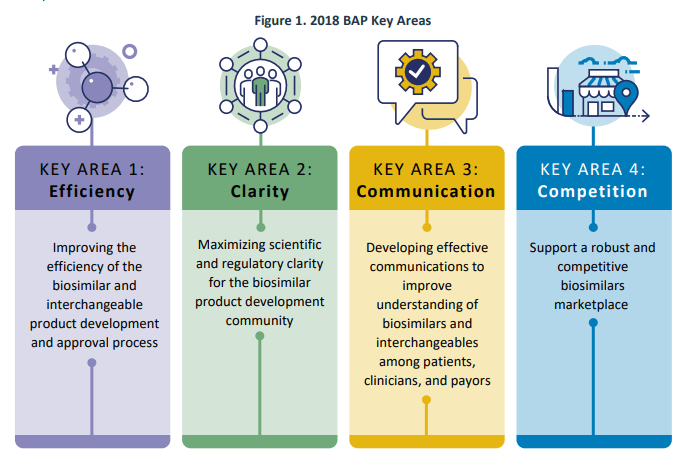
Pada bulan Juli 2018, FDA merilis Rencana Tindakan Biosimilar (BAP), yang menguraikan pendekatan FDA untuk memperluas akses terhadap biosimilar bagi masyarakat Amerika. Rencana tersebut berfokus pada 4 bidang utama:
Laporan FDA baru-baru ini meninjau beberapa pencapaian mereka sejak saat itu. Sebagian besar upaya ini berkisar pada dokumen panduan, staf tambahan, produk dan situs web pendidikan, dengar pendapat publik dan peraturan (yaitu peraturan yang diusulkan/final). FDA juga menambahkan sumber data baru termasuk penerbitan Buku Ungu versi modern pada Februari 2020. FDA juga bekerja sama dengan lembaga lain seperti FTC, dan menghasilkan pernyataan bersama serta mengadakan lokakarya pada Maret 2020 bertajuk: “Lokakarya Publik: Lokakarya FDA/FTC tentang Pasar Kompetitif untuk Biosimilar.” Beberapa tindakan penting lainnya tercantum di bawah ini.
Laporan lengkapnya adalah Di Sini.
NewsRoom.id